Grupa Błyszczuk
Tematyka badawcza: Patofizjologia zapalenia i zwłóknienia mięśnia sercowego
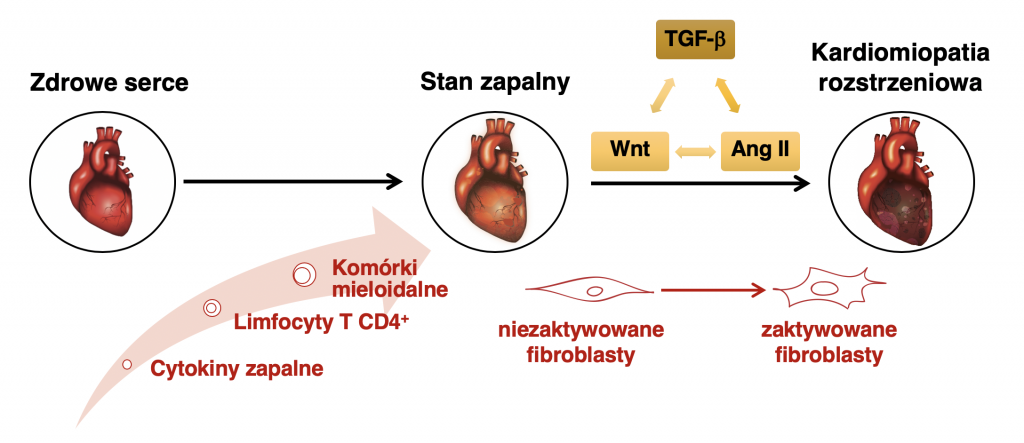
Problematyka badawcza: Zapalenie mięśnia sercowego jest schorzeniem kardiologicznym charakteryzującym się stanem zapalnym w śródsierdziu. U ludzi napływ komórek zapalnych do mięśnia sercowego może być spowodowany infekcjami wirusowymi, bakteryjnymi lub zakażeniami niektórymi pasożytami, a odpowiedź autoimmunologiczna skierowana przeciwko antygenom sercowym przyczynia się do rozwoju choroby. Część pacjentów z zapaleniem mięśnia sercowego rozwija kardiomiopatię rozstrzeniową, charakteryzującą się niewydolnością lewo- lub obukomorową, która powodowana jest pozapalnym zwłóknieniem śródmiąższowym i okołonaczyniowym. Mechanizmy patofizjologiczne będące odpowiedzialne za postęp choroby nie są do końca poznane, a obecne metody leczenia ograniczone.
Cel badań i metodologia: Celem naszych badań jest zrozumienie molekularnych i komórkowych mechanizmów odpowiadających za rozwój zapalenia i zwłóknienia w mięśniu sercowym. Zrozumienie tych mechanizmów pozwoli na rozwój nowych terapii skierowanych do pacjentów z zapalnymi schorzeniami kardiologicznymi. W naszych badaniach używamy mysiego modelu zapalenia mięśnia sercowego (ang. experimental autoimmune myocarditis), w którym to modelu immunizacja antygenami sercowymi powoduje aktywację limfocytów T CD4+ inicjujących napływ komórek zapalnych do mięśnia sercowego. Po ustąpieniu zapalenia, wiele zwierząt rozwija zwłóknienie oraz niewydolność lewokomorową. Badania na modelu mysim uzupełniane są badaniami in vitro i ex vivo na mysich i ludzkich komórkach pochodzących z mięśnia sercowego.
Projekty:
• Molekularne mechanizmy niewydolności prawokomorowej
• Molekularny mechanizm aktywacji fibroblastów w sercu
• Prozapalne i przeciwzapalne mechanizmy zależne od cytokiny TNF-α w zapaleniu mięśnia sercowego
• Rola autofagii w rozwoju zapalenia oraz zwłóknienia w mięśniu sercowym
• Odpowiedź prozwłóknieniowa śródbłonka mięśnia sercowego
Patofizjologia zapalenia mięśnia sercowego
Aktualni członkowie grupy:

Prof. dr hab. Przemysław Błyszczuk (kierownik)
mgr Magdalena Czepiec (doktorantka)
mgr Anna Dobosz (doktorantka)
mgr Maks Nęcki (doktorant)

dr Marcin Czepiel (post-doc)
Ex-członkowie grupy:

mgr Edyta Działo (doktorantka)

mgr Karolina Tkacz (doktorantka)

mgr Filip Rolski (doktorant)
mgr Marta Warszyńska(doktorantka)
dr Monika Stefańska (post-doc)
mgr Julia Cięciwa (pomoc techniczna)
Realizowane projekty:
Wybrane publikacje:
- Vdovenko D, Stefańska M, Wijnen WJ, Zarak-Crnkovic M, Bachmann M, Kania G, Camici GG, Lüscher TF, Eriksson U, Błyszczuk P. (2025), IL-23 promotes T cell trafficking in experimental autoimmune myocarditis, J Immunol. Aug 1;214(8):1926-1936.
- Cardiovasc Res. Feb 27;120(1):82-94
- Tkacz K, Rolski F, Stefańska M, Węglarczyk K, Szatanek R, Siedlar M, Kania G, Błyszczuk P. (2024), TGF-β Signalling Regulates Cytokine Production in Inflammatory Cardiac Macrophages during Experimental Autoimmune Myocarditis, Int J Mol Sci, May 21;25(11):5579.
- J Cardiovasc Dev Dis. Aug 18;10(8):352.
- Int J Mol Sci. Sep 17;22(18):10072
- Tkacz K, Rolski F, Czepiel M, Działo E, Siedlar M, Eriksson U, Kania G, Błyszczuk P. (2020) Haploinsufficient Rock1+/- and Rock2+/- mice are not protected from cardiac inflammation and postinflammatory fibrosis in experimental autoimmune myocarditis Cells Mar 12;9(3):700
- Rolski F, Błyszczuk P. (2020) Complexity of TNF-α signaling in heart disease J Clin Med. Oct 12;9(10)
- Zarak-Crnkovic M, Kania G, Jaźwa-Kusior A, Czepiel M, Wijnen WJ, Czyż J, Müller-Edenborn B, Vdovenko D, Lindner D, Gil-Cruz C, Bachmann M, Westermann D, Ludewig B, Distler O, Lüscher TF, Klingel K, Eriksson U, Błyszczuk P. (2019) Heart non-specific effector CD4+ T cells protect from postinflammatory fibrosis and cardiac dysfunction in experimental autoimmune myocarditis. Basic Res Cardiol. Dec 20;115(1):6
- Błyszczuk P (2019) Myocarditis in humans and in experimental animal models Front Cardiovasc Med. May 16;6:64
- Działo E, Rudnik M, Koning RI, Czepiel M, Tkacz K, Baj-Krzyworzeka M, Distler O, Siedlar M, Kania G, Błyszczuk P (2019) WNT3a and WNT5a transported by exosomes activate WNT signaling pathways in human cardiac fibroblasts Int J Mol Sci.Mar 21;20(6)
- Stellato M, Czepiel M, Distler O, Błyszczuk P, Kania G. (2019) Identification and isolation of cardiac fibroblasts from the adult mouse heart using two-color flow cytometry Front Cardiovasc Med. Aug 1;6:105
- Działo E, Tkacz K, Błyszczuk P. (2018) Crosstalk between TGF-β and WNT signalling pathways during cardiac fibrogenesis Acta Bioch. Pol. 65(3), 341-349
- Blyszczuk P, Müller-Edenborn B, Valenta T, Osto E, Stellato M, Behnke S, Glatz K, Basler K, Lüscher T, Distler O, Eriksson U, Kania G. (2017) TGF-β-dependent Wnt secretion controls myofibroblast formation and myocardial fibrosis progression in experimental autoimmune myocarditis Eur Heart J. May 7;38(18), 1413-1425
- Kania G, Siegert S, Behnke S, Prados-Rosales R, Casadevall A, Lüscher T, Luther S, Kopf M, Eriksson U, Blyszczuk P (2013) Activation of Toll-like receptor 2 in the presence of interferon-gamma signaling induce formation of regulatory nitric oxide-producing dendritic cells limiting T cell expansion in experimental autoimmune myocarditis, Circulation 127, 2285-94
- Blyszczuk P, Berthonneche C, Behnke S, Glönkler M, Moch H, Pedrazzini T, Lüscher TF, Eriksson U, Kania G. (2013) Nitric oxide synthase 2 is required for conversion of pro-fibrogenic inflammatory CD133+ progenitors into F4/80+ macrophages in experimental autoimmune myocarditis Cardiovasc Res. 97(2), 219-29
- Blyszczuk P, Behnke S, Lüscher TF, Eriksson U, Kania G. (2013) GM-CSF promotes inflammatory dendritic cell formation but does not contribute to disease progression in experimental autoimmune myocarditis BBA Mol. Cell Res. 1833(4), 934-44
- Kania G, Blyszczuk P, Stein S, Valaperti A, Germano D, Dirnhofer S, Hunziker L, Matter CM, Eriksson U. (2009) Heart-infiltrating prominin-1+/CD133+ progenitor cells represent the cellular source of TGF-β-mediated cardiac fibrosis in experimental autoimmune myocarditis. Circulation Res. 105(5), 462-70
- Blyszczuk P, Kania G, Dieterle T, Marty RR, Valaperti A, Berthonneche C, Pedrazzini T, Berger CT, Dirnhofer S, Matter CM, Penninger JM, Lüscher TF, Eriksson U. (2009) Myeloid differentiation factor-88/interleukin-1 signaling controls cardiac fibrosis and heart failure progression in inflammatory dilated cardiomyopathy. Circulation Res. 105(9), 912-20